Akero Therapeutics springt kräftig an! Positive Ergebnisse seiner Phase-2b-Studie für das Medikament Efruxifermin gemeldet!
Aufklärung über Eigenpositionen: Diese Aktien aus dem Artikel halten TraderFox-Redakteure aktuell
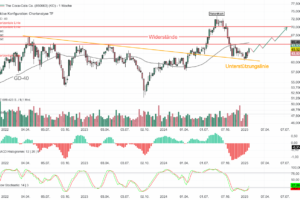
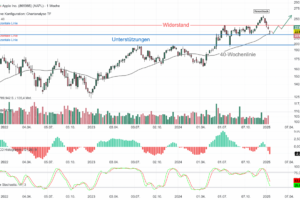
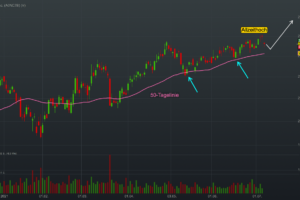
Der Aktienkurs von Akero Therapeutics (AKRO) stieg bis zum Börsenschluss am Montag, den 27. Januar 2025, um atemberaubende 97,52 % auf 51,72 USD an, nachdem das Unternehmen positive Langzeitergebnisse aus einer Phase-2b-Studie seines Lebermedikaments Efruxifermin zur Behandlung von metabolischer Dysfunktion in Verbindung mit Steatohepatitis, genannt MASH, verkündet hatte und eine erhebliche Marktchance in Aussicht stellt.
Leberzirrhose aufgrund von MASH hat eine hohe Todesfolge
Leberzirrhose aufgrund von MASH (metabolische Dysfunktion-assoziierte Steatohepatitis) ist eine lebensbedrohliche Krankheit mit hohem Risiko für Leberversagen, Krebs und schließlich Tod. Schätzungsweise werden bis 2030 mehr als 3 Mio. Amerikaner an MASH-Leberzirrhose leiden und ist damit die am schnellsten wachsende Ursache für Lebertransplantationen und Leberkrebs in den USA und Europa.
Hoffnungsträger ist Akeros Medikament Efruxifermin
Efruxifermin, abgekürzt EFX, ist der führende Medikamentenkandidat von Akero Therapeutics gegen MASH und wird derzeit in drei laufenden Phase-3-Studien untersucht. In mehreren Phase-2-Studien wurde beobachtet, dass EFX gewebeverändernde Fibrose, einschließlich kompensierter Zirrhose, umkehrt, MASH auflöst, nichtinvasive Marker für Fibrose und Leberschäden reduziert und die Insulinempfindlichkeit und das Lipoproteinprofil verbessert. EFX wurde entwickelt, um das biologische Aktivitätsprofil des natürlichen Hormons FGF21 nachzuahmen und ist für eine bequeme wöchentliche Dosierung konzipiert.
SYMMETRY-Studie soll erste Wirksamkeit bestätigen
Die Studie der Phase 2b untersuchte die Wirksamkeit und Sicherheit von EFX bei Patienten mit Biopsie bestätigter kompensierter Zirrhose aufgrund von MASH. An der Studie nahmen insgesamt 182 Patienten teil, die randomisiert einmal wöchentlich 28 mg oder 50 mg EFX oder Placebo über 36 Wochen erhielten, von denen 181 mindestens eine Studiendosis erhielten. Der primäre Wirksamkeitsendpunkt der Studie war der Anteil der Patienten, die in Woche 36 mindestens eine Verbesserung der Fibrose um ein Stadium ohne Verschlechterung von MASH erreichten. Zu den sekundären Messungen in Woche 96 gehörten eine Verbesserung der Fibrose um mindestens ein Stadium und keine Verschlechterung von MASH, MASH-Auflösung, Veränderung der Leberenzyme gegenüber dem Ausgangswert, nichtinvasive Marker für Leberfibrose, glykämische Kontrolle und Lipoproteine sowie Sicherheits- und Verträglichkeitsmessungen.
Die Daten der Biopsien von Patienten zu Studienbeginn und in Woche 96 zeigten nun, dass sich bei 39 % der mit 50 mg EFX behandelten Gruppe eine Verbesserung der Fibrose um mindestens ein Stadium ohne Verschlechterung der MASH eingestellt hat. Dies entspricht einer Effektstärke von 24 % gegenüber dem Placebo mit 15 %. Akero Therapeutics gab an, das Medikament sei im Allgemeinen gut verträglich und es habe in der EFX-Gruppe keine Todesfälle gegeben. Die häufigsten Nebenwirkungen waren vom Grad 1 oder 2 und gastrointestinalen Ursprungs, wie Durchfall, Übelkeit oder gesteigertem Appetit. CEO Andrew Cheng freue sich auf die weitere Evaluierung von 50 mg EFX in den laufenden Phase-3-Studien.
SYNCHRONY-Studie sind Phase 3-Tests
Das SYNCHRONY-Programm der Phase 3 baut auf den Ergebnissen zweier klinischer Studien der Phase 2b auf, der HARMONY-Studie bei Patienten mit präzirrhotischer MASH und der eben verkündeten Ergebnissen der SYMMETRY-Studie bei Patienten mit kompensierter Zirrhose aufgrund von MASH. Der Produktkandidat EFX wird derzeit in drei laufenden klinischen Studien der Phase 3 untersucht. SYNCHRONY Histology bei Patienten mit präzirrhotischer MASH, SYNCHRONY Outcomes bei Patienten mit kompensierter Zirrhose aufgrund von MASH und SYNCHRONY Real-World bei Patienten mit MASH oder MASLD, einer Fettlebererkrankung im Zusammenhang mit Stoffwechselstörungen. Die Bedeutung von Phase-3-Studien kann nicht genug betont werden. Sie sind der letzte Schritt, bevor ein neues Medikament eine Zulassung erhält und auf den Markt kommen kann.
Akero Therapeutics kündigt geplantes öffentliches Angebot von Stammaktien an
Bereits am selben Tag der Veröffentlichung der Phase 2b Ergebnisse hat Akero Therapeutics bekanntgegeben, dass man ein öffentliches Zeichnungsangebot für Stammaktien im Wert von 300 Mio. USD gestartet hat. Die Aktien werden direkt von Akero angeboten und den Zeichnungsgebern wird eine 30-tägige Option zum Kauf von Stammaktien im Wert von bis zu 45 Mio. USD zum öffentlichen Zeichnungspreis eingeräumt.



















 & Profi-Tools von
& Profi-Tools von