FDA lehnt Alzheimer-Präparat von Eli Lilly ab und fordert mehr Daten
Aufklärung über Eigenpositionen: Diese Aktien aus dem Artikel halten TraderFox-Redakteure aktuell
Die FDA fordert mehr Daten
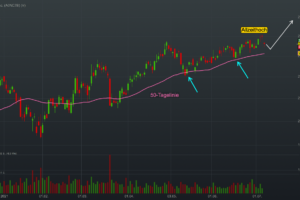
Die FDA hat bisher zwei Alzheimer-Medikamenten eine beschleunigte Zulassung erteilt. Die Amyloid-Plaque-Bekämpfungstherapie von Eli Lilly wird nicht das dritte sein. Das Lilly-Präparat hat immer noch eine Chance, die Zulassung zu erhalten, aber es wird mehr Daten und mehr Zeit benötigen.
Nach Angaben von Lilly bemängelte die FDA das Fehlen von Daten von Patienten, die mindestens 12 Monate lang mit dem Medikament Donanemab behandelt worden sind. Die Behörde möchte solche Daten von mindestens 100 Patienten sehen.
"Die Studie umfasste zwar mehr als 100 Patienten, die mit Donanemab behandelt wurden, doch aufgrund des schnellen Abbaus der Plaques konnten viele Patienten die Behandlung bereits nach sechs Monaten beenden, so dass weniger als 100 Patienten 12 Monate lang mit Donanemab behandelt wurden", so Lilly. "Die FDA wies darauf hin, dass die Daten zur Erfüllung der Expositionserwartung wahrscheinlich die unverblindeten kontrollierten Sicherheitsdaten von TRAILBLAZER-ALZ 2 nach Abschluss der Studie einschließen müssten."
Wann kommen die Daten?
TRAILBLAZER-ALZ 2 ist die derzeit laufende bestätigende Phase-3-Studie. Vorläufige Daten aus dieser Studie werden für das zweite Quartal dieses Jahres erwartet. Sobald diese Ergebnisse vorliegen, werden sie laut Lilly die Grundlage für einen Antrag auf eine herkömmliche behördliche Zulassung bilden.
Abgesehen von den fehlenden Daten für mindestens 100 Patienten nach einem Jahr Behandlung hat die FDA laut Lilly keine weiteren Probleme mit dem Antrag angeführt. "Wir freuen uns auf die bevorstehenden bestätigenden Ergebnisse der Phase 3 von TRAILBLAZER-ALZ 2 und die anschließende Einreichung bei der FDA, die wir immer als die wichtigsten nächsten Schritte für die Patienten angesehen haben", sagte Anne White, Executive Vice President von Lilly Neuroscience, in einer vorbereiteten Erklärung. "Wir gehen davon aus, dass diese Studie das Nutzen- und Sicherheitsprofil bestätigen wird, das wir in der Phase-2-Studie zu TRAILBLAZER-ALZ beobachtet haben, und glauben, dass Patienten und Ärzte gut damit bedient sind, wenn sie neben unseren Phase-2-Daten auch die vollständigen Phase-3-Daten zur Verfügung haben, wenn sie Behandlungsentscheidungen treffen müssen."
















 & Profi-Tools von
& Profi-Tools von